Az éghajlatváltozás “mellékhatásai”: a tengervíz és a csapadékvíz savasodása
2019.12.31.Az óceán az egyik, ha nem a legmeghatározóbb tényező, ami alakítja Földünk éghajlatát. Ennek megfelelően az éghajlatváltozásban betöltött szerepe is kulcsfontosságú: az óceán nyeli el a legtöbb hőt és a legtöbb üvegházhatású gázt, ami azonban elkezdte megváltoztatni ennek a hatalmas a rendszernek a működését és az összetételét is. A környezetvédelem iránt fogékony emberek számára azonnal a korallzátonyok pusztulása, az oxigénhiányos területek növekedése és a vizek savasodása juthat eszébe. Az alábbi cikk az óceánok és a csapadék éghajlatváltozás miatti elsavasodását vizsgálja, és mint általában a klímaváltozással kapcsolatban, itt is hamar kiderül: a képlet nem olyan egyszerű, mint elsőre gondolnánk. Kovács Attila vendégcikke.
- Az óceán és a csapadék savasodik, de csak lassan és elvileg az élőlények védekeznek ellene.
- Az emberi hatáshoz képest a természetes időbeli és térbeli változékonyság nagy.
- A klímaváltozás mérsékli a savasodást, illetve az algák felfokozott biológiai aktivitása is.
- Tenni nem igazán tudunk ellene, a tengervíz felmelegedése nagyobb probléma, ami pedig a klímaváltozás része.
- A vélemények megoszlanak, még nem teljesen világos, hogy mennyire veszélyes vagy ártalmatlan a jelenség.
- A múltban volt nagyobb is a szén-dioxid koncentráció, az óceánok savasabbak voltak, mégis voltak mészváz-építő tengeri lények.
Gázok beoldódása
A halak számára nélkülözhetetlen oxigénhez hasonlóan azt tapasztaljuk, hogy a légkörben található gázok bekerülnek, más szóval beoldódnak a csapadékba, folyókba, tavakba és más vizekbe. Az óceánok vizének savasodása is ezen folyamat során történik, a beoldódás pedig addig zajlik, amíg a víz telítetté nem válik az adott gázra. Általános esetben egy beoldódott gáz maximális mennyiségét úgy számíthatjuk ki, ha a gáz parciális nyomását (hozzájárulását az azt tartalmazó, több gáz alkotta elegy nyomásához) megszorozzuk egy megfelelő állandóval, amely kapcsolatot teremt a koncentráció (C) és a nyomás (p) között.
Fontos megjegyezni, hogy ez az állandó hőmérsékletfüggő! Az óceán vizének oxigéntartalma például nagy mértékben függ a víz hőmérsékletétől: általában a hidegebb, oxigéndúsabb tengervízben találunk több tengeri állatot. Más szavakkal minél nagyobb a víz (vagy más folyadék) hőmérséklete, annál gyengébben tart magában beoldott gázokat.
pH érték
A vizes oldatok kémhatásának mérésére a pH értéket használjuk, amely egy 0 és 14 közötti szám. Ha egy oldat pH értéke 0 és 7 közé esik, akkor savról beszélünk, ha pedig 7 és 14 közé, akkor bázisról, más néven lúgról. A skálán a 7-es kitüntetett szerepű, hiszen ez a semleges kémhatást jelöli, vagyis a desztillált vizet. Néhány ismertebb anyag pH értéke:
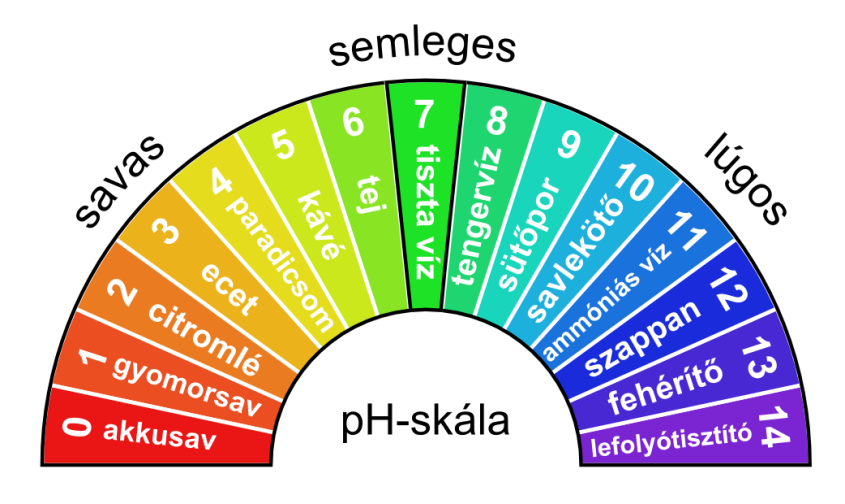
A Földön a pH érték egészen szélsőséges értékeket is felvehet. Az egyik legsavasabb természetes hely az Ijen tó, amely Indonéziában a Kawah Ijen vulkán mellett fekszik, pH-ja a tó közepén 0,13 (kénsavas). A leglúgosabb tó a tanzániai Nátron-tó, amelynek pH-ja 12. A talajok is különböző pH-val rendelkeznek: az esőerdőkben savas kémhatásúak (pH = 4–5), ezzel szemben a sivatagokban lúgosak (pH = 7–8).
A savak pozitív töltésű protonokat adnak át, és csökkentik a pH-t, a bázisok pedig protonokat vesznek fel, és növelik a pH-t. Egy sav és egy bázis kémiai reakciója során a sav egyik sója és víz képződik, például a sósav (HCl) és a nátrium-hidroxid (NaOH) egyesülése konyhasót (NaCl) és vizet eredményez.
A pH-t hidrogénion-kitevőnek is nevezik, ugyanis ez mutatja meg, hogy mekkora az oldat hidrogénion- (H+), azaz proton-koncentrációja. A pH értéket úgy kapjuk meg, ha a vizes oldat hidrogénion-koncentrációjának tízes alapú logaritmusát vesszük, és az eredményt megszorozzuk (−1)-gyel:
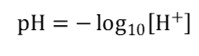
A logaritmikus összefüggés miatt, ha egy oldat pH-ja 1-gyel csökken, akkor a benne lévő hidrogénion-koncentráció, azaz a savasság már 10-szeresére nőtt!
Vizes oldatban a H+ ion hozzákapcsolódik a poláros vízmolekulához és oxóniumiont (H3O+) alkot, a megmaradt negatív ion pedig a hidroxidion (OH−). A tiszta vízben a proton-csere folyamatosan oda-vissza lezajlik, ezt nevezzük a víz autoprotolízisének. Mivel a tiszta víz elektromosan semleges, pH-ja pedig 7, ezért a benne az oxóniumion és a hidroxidion koncentrációja egyaránt 10−7 mol/liter. A két koncentráció szorzata a vízionszorzat, amely (25 °C-on) Kvíz = 10−14 mol2/liter2.
Az óceánok vize
Először határozzuk meg az óceánok pH-ját egy olyan feltételezett esetben, amikor vizükbe nem oldódnak be gázok a légkörből! A tengervíznek azért magas a sótartalma, mert a tengervíz és a csapadékvíz ásványi anyagokat old ki a tengerfenékről, illetve más kőzetekből. A sós tengervíz sok pozitív iont (kationt), például nátrium- (Na+), magnézium- (Mg2+), kalcium- (Ca2+), és káliumiont (K+) tartalmaz erős bázisokból, de találunk benne erős savakból származó negatív ionokat (anionok), főként klór- (Cl−) és szulfátionokat (SO42−) is. A pozitív ionok száma kis mértékben meghaladja a negatív ionok számát, a többlet töltést pedig lúgosságnak nevezzük, és [A]-val jelöljük.
Ha összeadjuk a pozitív ionok számát a lúgossággal, akkor ennek meg kell egyeznie a negatív ionok koncentrációjával. Mindkét oldalt beszorozva a protonkoncentrációval, majd az egyenletet átrendezve egy másodfokú egyenletet kapunk, amelyet megoldva meghatározhatjuk a hidrogénion-koncentrációt (a negatív végeredményt, mint koncentrációt nem értelmezzük), amiből az óceán átlagos kémhatására pHóceán = 11,36-ot kapunk.
Az óceánok tehát erősen lúgosak lennének, ha vizükbe nem oldódnának be gyenge savakat képző gázok. A legjelentősebb ilyen gáz a szén-dioxid, amelynek vizes oldata a szénsav (H2CO3), ami aztán protonra és hidrogénkarbonátionra (HCO3−) esik szét. A reakciók oda-vissza lejátszódnak, a szén-dioxid pedig egyensúlyba kerül a szénsavval. Így e „tompító” savak révén a jelenlegi átlagos pHóceán = 8,1 körül van. A „savasodás” kifejezés tehát inkább csak a pH-változás irányát jellemzi, az óceánok vize a só miatt továbbra is lúgos marad.
Összességében az emberi hatások miatt a tengervíz 30%-kal lett savasabb az ipari forradalom óta, pH-ja átlagosan 0,1-del csökkent, miközben a légköri szén-dioxid koncentráció másfélszeresére nőtt (270 ppm-ről 400 ppm-re).
Ha megduplázzuk a szén-dioxid koncentrációt 400 ppm-ről 800 ppm-re (ez várhatóan 2100-ra fog megtörténni), akkor az óceánok pH értéke 8,1-ről 7,9-re csökken. Igaz, hogy ez csak 0,2-es változást jelent a pH-ban, azonban ne felejtsük el, hogy a pH logaritmikus érték, az ionkoncentráció és a savasság majdnem 60%-kal nőne.
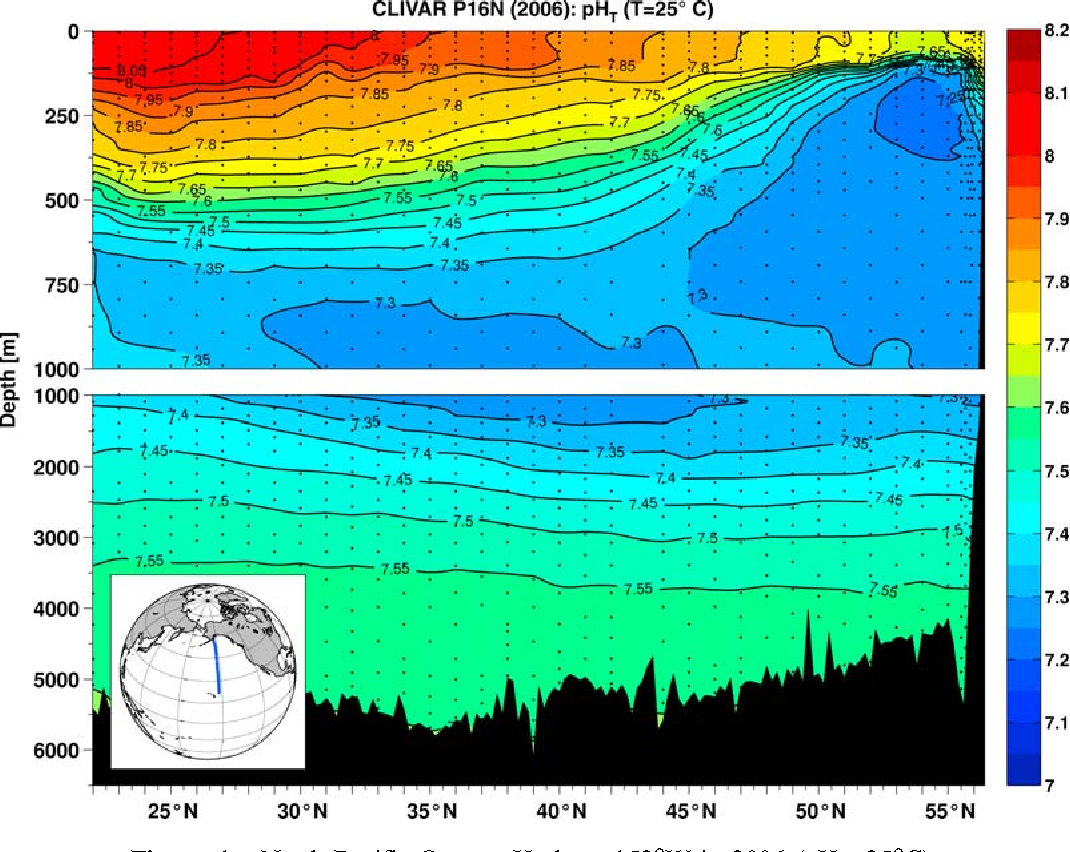
Azonban nem kell megijednünk. Az óceánok pH-ja nem érzékeny a légköri szén-dioxid koncentrációjának nagy változásaira, illetve az emiatt bekövetkező pH-változások elhanyagolhatóak az óceáni pH térbeli és időbeli természetes változékonyságához képest (lásd 1. és 2. ábra).
Az is kijelenthető továbbá, hogy az óceánok szén-dioxid elnyelő képessége a szén-dioxid légköri koncentrációjának növekedésével csökken.
Az óceánok vizének felső rétege a szén-dioxid tekintetében már most is túltelített állapotban van, az alsóbb rétegekbe való lekeveredés pedig lassú. Érdekes módon az alsóbb vízrétegek pH-ja kisebb (akár 7,3, lásd 2. ábra), mint a felszíni vizeké, mivel hőmérsékletük is kisebb, beoldott szén-dioxid koncentrációjuk pedig nagyobb. Ha tehát a mélyből víz emelkedik fel, akkor ez pH-csökkenést is eredményez. A korallzátonyoknál mérhető napi pH akár 7,8 és 8,3 között is ingadozhat (Hennige, 2014), a szubtrópusi óceáni területek pH-jának évszakos változékonysága pedig 8,05-től (melegebb hónapok) 8,15-ig (hidegebb hónapok) terjed (Takahashi et al., 2014).
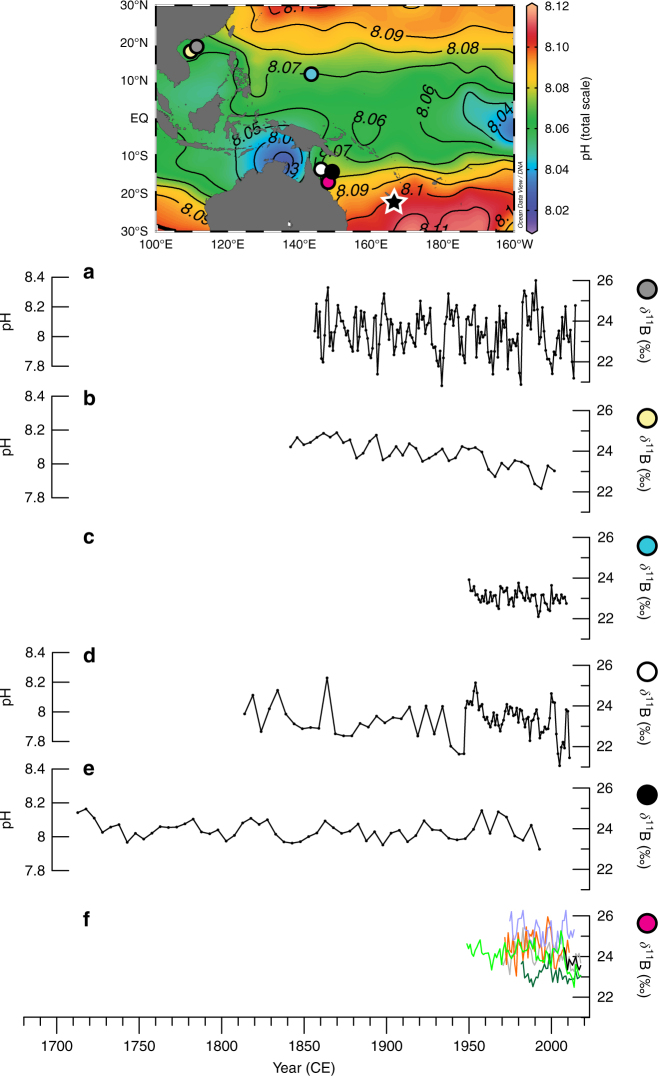
Az óceáni pH csökkenését két hatás is mérsékli: a globális felmelegedés csökkenti az óceánok szén-dioxid koncentrációját, hiszen a légköri gázok gyengébben képesek beoldódni a melegebb vizekbe; emellett a fotoszintézist folytató növényi életformák (algák) fokozottabb biológiai aktivitást mutatnak magasabb beoldott szén-dioxid-szint mellett, amit fel is használnak, ezért növelik a pH-t.
Hatás az élővilágra
A vélemények megoszlanak az óceánok pH-csökkenésének hatásait illetően. A biológusok természetesen aggódnak a tengeri élővilág miatt, az óceán pH-ját vizsgáló kutatók azonban kevésbé borúlátóak, és bíznak az állatok védelmi mechanizmusaiban.
Jelenleg a felszíni tengervíz a szén-dioxid mellett túltelített a kalciumkarbonátban (CaCO3) is, így az olyan élőlények, mint a kagylók, tengeri sünök, osztrigák, korallok és mészmoszatok (Coccolithophore) sekélyebb vizekben könnyen felépítik ebből mészvázukat. Csak túl mélyen, az ún. lizoklin zóna (kb. 3700‒4500 m) alatt nem képesek erre, ahol a telítettség csökken, a CaCO3 oldhatósága nő, a mészvázak pedig feloldódnak a vízben. A szén-dioxid légköri koncentrációja lassan változik, így ezek az organizmusok alkalmazkodni tudnak az emiatt bekövetkező (szintén lassú) pH-változáshoz (szerves védőréteggel vonják be mészvázaikat, így védekeznek a természetes pH-változások ellen is). Mészvázat építő fejlábas állatok (ammonoideák) a jura korban, úgy 180 millió évvel ezelőtt is éltek az óceánokban, amikor a szén-dioxid légkör koncentrációja elérte a 2000 ppm-es értéket is, a tengervíz átlagos pH-ja pedig akár 7,5 is lehetett.
A korallok kifehéredését tehát nagy valószínűséggel nem a pH-csökkenés, hanem a tengervíz globális klímaváltozás miatti felmelegedése okozza.
A csapadékvíz
Az óceánok vizével ellentétben a csapadékvíz légkörtől független lúgossága gyakorlatilag nulla, így az abba beoldódó szén-dioxid miatt természetes savassággal bír. Az esővíz pH-jának meghatározásához tekintsük az alábbi kémiai reakciókat:
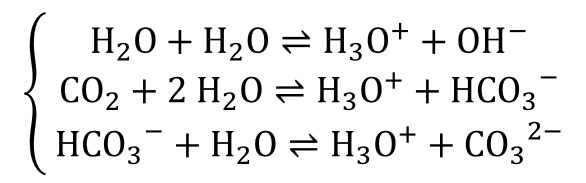
Az első reakció a korábban már említett autoprotolízis, a második folyamatban hidrogénkarbonátion (HCO0−), a harmadikban pedig karbonátion (CO32−) keletkezik, a reakciók oda-vissza lejátszódnak. A teljes oxóniumion-koncentráció a három részkoncentráció összege, a csapadékvíz pH-jára pedig (400 ppm légköri szén-dioxid koncentráció mellett) pHeső = 5,59 adódik.
Az esővíz tehát enyhén savas kémhatású, savas esőnek pedig akkor tekintjük, ha pH-ja kisebb, mint 5,0. A legnagyobb gondot a magas kéntartalmú szén elégetése okozza. A felszabaduló kén-dioxid (SO2) vizes környezetben kénsavat képez (H2SO4), melynek pH-ja 1 körüli. A legsavasabb esők az Egyesült Államokban az 1970-80-as években voltak, amelyek legalacsonyabb pH-ja elérte a 2,1-es értéket (ami 1000-szer savasabb, mint az esővíz természetes savassága) is (Likens et al., 1974). Skandináviában a savas esők pH értéke 2,8-re is lecsökkent az 1960-as években (Likens et al., 1972).
Mennyi lenne a csapadékvíz pH-ja, ha a szén-dioxid koncentrációja a duplájára (800 ppm-re) nőne? Elvégezve a fenti számításokat az új értékkel pHeső(800 ppm) = 5,44 adódik.
A változás mértéke pH-ban 0,15, ez savasságban 40%-os növekedést jelent. Nehéz megválaszolni azt a kérdést, hogy ez pontosan mekkora hatással lesz a környezetre. Hasonlóan az óceáni pH-csökkenéshez a lassú változás elvileg itt sem okoz problémát, de ehhez még további kutatásokat kell elvégezni.
Írta: Kovács Attila – Meteorológus-éghajlatkutató, doktorandusz az ELTE TTK Meteorológiai Tanszékén











